Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое Термоядерные реакции - определение
РАЗНОВИДНОСТЬ ЯДЕРНОЙ РЕАКЦИИ, ПРИ КОТОРОЙ ЛЁГКИЕ АТОМНЫЕ ЯДРА ОБЪЕДИНЯЮТСЯ В БОЛЕЕ ТЯЖЁЛЫЕ ЗА СЧЕТ КИНЕТИЧЕСКОЙ ЭНЕРГИИ ИХ ТЕПЛОВОГО ДВИ
Термоядерный синтез; Термоядерные реакции; Ядерный синтез; Термояд; Реакция синтеза
Найдено результатов: 122
ТЕРМОЯДЕРНЫЕ РЕАКЦИИ
реакции слияния легких ядер в более тяжелые, происходящие при высоких температурах. Сопровождаются выделением энергии; основной источник энергии Солнца и др. звезд (см. также Управляемый термоядерный синтез).
Термоядерные реакции
ядерные реакции между лёгкими атомными ядрами, протекающие при очень высоких температурах (порядка 107 К и выше). Высокие температуры, то есть достаточно большие относительные энергии сталкивающихся ядер, необходимы для преодоления электростатического барьера, обусловленного взаимным отталкиванием ядер (как одноимённо заряженных частиц). Без этого невозможно сближение ядер на расстояние порядка радиуса действия ядерных сил, а следовательно, и "перестройка" ядер, происходящая при Т. р. Поэтому Т. р. в природных условиях протекают лишь в недрах звёзд, а для их осуществления на Земле необходимо сильно разогреть вещество ядерным взрывом, мощным газовым разрядом, гигантским импульсом лазерного излучения или бомбардировкой интенсивным пучком частиц.
Т. р., как правило, представляют собой процессы образования сильно связанных ядер из более рыхлых и потому сопровождаются выделением энергии (точнее, выделением в продуктах реакции избыточной кинетической энергии, равной увеличению энергии связи). При этом сам механизм этого "экзоэнергетического" сдвига к средней части периодической системы элементов Менделеева здесь противоположен тому, который имеет место при делении тяжёлых ядер: почти все практически интересные Т. р. - это реакции слияния (синтеза) лёгких ядер в более тяжёлые. Имеются, однако, исключения: благодаря особой прочности ядра 4He (α-частица) возможны экзоэнергетические реакции деления лёгких ядер (одна из них, "чистая" реакция 11B + р → 34Не + 8,6 Мэв, привлекла к себе интерес в самое последнее время).
Большое энерговыделение в ряде Т. р. обусловливает важность их изучения для астрофизики, а также для прикладной ядерной физики и ядерной энергетики. Кроме того, чрезвычайно интересна роль Т. р. в дозвёздных и звёздных процессах синтеза атомных ядер химических элементов (нуклеогенеза).
Скорости Т. р. В табл. 1 для ряда Т. р. приведены значения энерговыделения, основной величины, характеризующей вероятность Т. р. - её максимального эффективного поперечного сечения (См. Эффективное поперечное сечение) (σмакс, и соответствующей энергии налетающей (в формуле реакции - первой слева) частицы.
Главная причина очень большого разброса сечений Т. р. - резкое различие вероятностей собственно ядерных ("послебарьерных") превращений. Так, для большинства реакций, сопровождающихся образованием наиболее сильно связанного ядра 4He, сечение велико, тогда как для реакций, обусловленных слабым взаимодействием (См. Слабые взаимодействия) (например, р + р → D + е+ + ν), оно весьма мало.
Т. р. происходят в результате парных столкновений между ядрами, поэтому число их в единице объёма в единицу времени равно n1n2 <vσ(v) >, где n1, n2 - концентрации ядер 1-го и 2-го сортов (если ядра одного сорта, то n1n2 ñëåäóåò çàìåíèòü íà 1/2n2), v - относительная скорость сталкивающихся ядер, угловые скобки означают усреднение по скоростям ядер v [распределение которых в дальнейшем принимается максвелловским (см. Максвелла распределение)].
Температурная зависимость скорости Т. р. определяется множителем < vσ(v) >. В практически важном случае "не очень высоких" температур T < (107÷108) К она может быть приближённо выражена в виде, одинаковом для всех Т. р. В этом случае относительные энергии Е сталкивающихся ядер, как правило, значительно ниже высоты кулоновского барьера (последняя даже для комбинации ядер с наименьшим зарядом z = 1 составляет Термоядерные реакции 200 Кэв, что соответствует, по соотношению E = kT, T Термоядерные реакции 2․109 K) и, следовательно, вид σ(v) определяется в основном вероятностью "туннельного" прохождения сквозь барьер (см. Туннельный эффект), а не собственно ядерным взаимодействием, в ряде случаев обусловливающим "резонансный" характер зависимости σ(v) (именно такая зависимость проявляется в наибольших из значений σмакс в таблице 1). Результат имеет вид
< vσ(v) > = const․Т-2/3ехр}
где const - постоянная, характерная для данной реакции, Z1, Z2 - заряды сталкивающихся ядер, 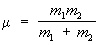 - их приведённая масса, е - заряд электрона, η - Планка постоянная, k - Больцмана постоянная.
- их приведённая масса, е - заряд электрона, η - Планка постоянная, k - Больцмана постоянная.
Таблица 1
p - протон, D - дейтрон (ядро дейтерия 2H), Т - тритон (ядро трития 3H), n - нейтрон, е+ - позитрон, v - нейтрино, γ - фотон.
Т. р. во Вселенной играют двоякую роль - как основной источник энергии звёзд и как механизм нуклеогенеза. Для нормальных гомогенных звезд, в том числе Солнца, главным процессом экзоэнергетического ядерного синтеза является сгорание Н в Не, точнее, превращение 4 протонов в ядро 4He и 2 позитрона. Этот результат можно получить двумя путями (Х. Бете и др., 1938-39): 1) в протон - протонной (рр) цепочке, или водородном цикле; 2) в углеродно-азотном (CN), или углеродном, цикле (таблицы 2 и 3).
Первые 3 реакции входят в полный цикл дважды. Времена реакций рассчитаны для условий в центре Солнца: Т = 13 млн К (по другим данным - 16 млн К), плотность Н - 100 г /см3. В скобках указана часть энерговыделения, безвозвратно уходящая с ν.
В CN-цикле ядро 12С играет роль катализатора. Для Солнца и менее ярких звёзд в полном энерговыделении преобладает рр-цикл, а для более ярких звёзд - CN-цикл.
Табл. 2. - Водородный цикл
Водородный цикл разветвляется на 3 варианта. При достаточно больших концентрациях 4He и T > (10 ÷ 15) млн К, в полном энерговыделении начинает преобладать др. ветвь рр-цикла, отличающаяся от приведённой в таблице 2 заменой реакции 3He + 3He на цепочку:
3He + 4He → 7Be + γ, 7Be + e- → 7Li + γ,
p + 7Li → 24He,
а при ещё более высоких Т - третья ветвь:
3He + 4He → 7Be + γ, р + 7Ве → 8В + γ,
8B → 8Be + e+ + ν, 8Be → 24He.
Для звёзд-гигантов с плотными выгоревшими (по содержанию Н) ядрами существенны гелиевый и неоновый циклы Т. р.; они протекают при значительно более высоких температурах и плотностях, чем рр- и CN-циклы. Основной реакцией гелиевого цикла, идущей, начиная с T ≈ 200 млн К, является так называемый процесс Солпитера: 34He → 12C + γ1 + γ2 + 7,3 Мэв (процесс не строго тройной, а двухступенчатый, идущий через промежуточное ядро 8Be). Далее могут следовать реакции 12C +4Не → 16O + γ, 16O + 4He → 20Ne + γ; в этом состоит один из механизмов нуклеогенеза. Возможность процесса Солпитера, а тем самым и нуклеогенеза большинства элементов (предпосылка возникновения всех форм жизни!) связана с таким случайным обстоятельством, как большая "острота" резонанса в ядерной реакции 34Не → 12С, обеспечиваемая наличием подходящего дискретного уровня энергии у ядра 8Be.
Если продукты реакций гелиевого цикла вступят в контакт с Н, то осуществляется неоновый (Ne-Na) цикл, в котором ядро 20Ne играет роль катализатора для процесса сгорания Н в Не. Последовательность реакций здесь вполне аналогична CN-циклу (табл. 3), только ядра 12C, 13N, 13C, 14N, 15O, 15N заменяются соответственно ядрами20Ne, 21Na, 21Ne, 22Na, 23Na, 23Mg.
Табл. 3. - Углеродный цикл
Мощность этого цикла как источника энергии невелика. Однако он, по-видимому, имеет большое значение для нуклеогенеза, так как одно из промежуточных ядер цикла (21Ne) может служить источником нейтронов: 21Ne + 4He → 24Mg + n (аналогичную роль может играть и ядро С, участвующее в CN-цикле). Последующий "цепной" захват нейтронов, чередующийся с процессами β--распада, является механизмом синтеза всё более тяжёлых ядер.
Средняя интенсивность энерговыделения ε в типичных звёздных Т. р. по земным масштабам ничтожна. Так, для Солнца (в среднем на 1 г солнечной массы) 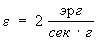 . Это гораздо меньше, например, скорости энерговыделения в живом организме в процессе обмена веществ. Однако вследствие огромной массы Солнца (2․1033г) полная излучаемая им мощность (4․1026 вт) чрезвычайно велика (она соответствует ежесекундному уменьшению массы Солнца на Термоядерные реакции 4 млн. т) и даже ничтожной её доли достаточно, чтобы оказывать решающее влияние на энергетический баланс земной поверхности, жизни и т. д.
. Это гораздо меньше, например, скорости энерговыделения в живом организме в процессе обмена веществ. Однако вследствие огромной массы Солнца (2․1033г) полная излучаемая им мощность (4․1026 вт) чрезвычайно велика (она соответствует ежесекундному уменьшению массы Солнца на Термоядерные реакции 4 млн. т) и даже ничтожной её доли достаточно, чтобы оказывать решающее влияние на энергетический баланс земной поверхности, жизни и т. д.
Из-за колоссальных размеров и масс Солнца и звёзд в них идеально решается проблема удержания (в данном случае - гравитационного) и термоизоляции плазмы: Т. р. протекают в горячем ядре звезды, а теплоотдача происходит с удалённой и гораздо более холодной поверхности. Только поэтому звёзды могут эффективно генерировать энергию в таких медленных процессах, как рр- и CN-циклы (табл. 2 и 3). В земных условиях эти процессы практически неосуществимы; например, фундаментальная реакция р + p → D + е+ + ν непосредственно вообще не наблюдалась.
Т. р. в земных условиях. На Земле имеет смысл использовать лишь наиболее эффективные из Т. р., связанные с участием изотопов водорода D и Т. Подобные Т. р. в сравнительно крупных масштабах осуществлены пока только в испытательных взрывах термоядерных, или водородных бомб (см. Ядерное оружие). Энергия, высвобождающаяся при взрыве такой бомбы (1023- 1024эрг), превышает недельную выработку электроэнергии на всём земном шаре и сравнима с энергией землетрясений и ураганов. Вероятная схема реакций в термоядерной бомбе включает Т. р. 12, 7, 4 и 5 (табл. 1). В связи с термоядерными взрывами обсуждались и др. Т. р., например 16,14, 3.
Путём использования Т. р. в мирных целях может явиться Управляемый термоядерный синтез (УТС), с которым связывают надежды на решение энергетических проблем человечества, поскольку дейтерий, содержащийся в воде океанов, представляет собой практически неисчерпаемый источник дешёвого горючего для управляемых Т. р. Наибольший прогресс в исследованиях по УТС достигнут в рамках советской программы "Токамак". Аналогичные программы к середине 70-х гг. 20 в. стали энергично развиваться и в ряде др. стран. Для УТС наиболее важны Т. р. 7,5 и 4 [а также 12 для регенерации дорогостоящего Т]. Независимо от энергетических целей термоядерный реактор может быть использован в качестве мощного источника быстрых нейтронов. Однако значительное внимание привлекли к себе и "чистые" Т. р., не дающие нейтронов, например 10, 20 (табл. 1).
Лит.: Арцимович Л. А., Управляемые термоядерные реакции, 2 изд., М., 1963; Франк-Каменецкий Д. А., Физические процессы внутри звезд, М., 1959; Термоядерные реакции, в кн.: Проблемы современной физики, М., 1954, в. 1; Fowler W. A., Caughlan G. R., Zimmerman В. A., "Annual Review of Astronomy and Astrophysics", 1967, v. 5, p. 525.
В. И. Коган.
Термоядерная реакция
Термоя́дерная реа́кция — разновидность ядерной реакции, при которой лёгкие атомные ядра объединяются в более тяжёлые за счёт кинетической энергии их теплового движения.
ЯДЕРНЫЙ СИНТЕЗ
термоядерный синтез, реакция слияния легких атомных ядер в более тяжелые ядра, происходящая при сверхвысокой температуре и сопровождающаяся выделением огромных количеств энергии. Ядерный синтез - это реакция, обратная делению атомов: в последней энергия выделяется за счет расщепления тяжелых ядер на более легкие. См. также ЯДЕР ДЕЛЕНИЕ; АТОМНАЯ ЭНЕРГЕТИКА.
Согласно современным астрофизическим представлениям, основным источником энергии Солнца и других звезд является происходящий в их недрах термоядерный синтез. В земных условиях он осуществляется при взрыве водородной бомбы. Термоядерный синтез сопровождается колоссальным энерговыделением на единицу массы реагирующих веществ (примерно в 10 миллионов раз большим, чем в химических реакциях). Поэтому представляет большой интерес овладеть этим процессом и на его основе создать дешевый и экологически чистый источник энергии. Однако несмотря на то, что исследованиями управляемого термоядерного синтеза (УТС) заняты большие научно-технические коллективы во многих развитых странах, предстоит решить еще немало сложных проблем, прежде чем промышленное производство термоядерной энергии станет реальностью.
Современные атомные станции, использующие процесс деления, лишь отчасти удовлетворяют мировые потребности в электроэнергии. Топливом для них служат естественные радиоактивные элементы уран и торий, распространенность и запасы которых в природе весьма ограничены; поэтому для многих стран возникает проблема их импорта. Главным компонентом термоядерного топлива является изотоп водорода дейтерий, который содержится в морской воде. Запасы его общедоступны и очень велики (мировой океан покрывает ?71% площади поверхности Земли, а на долю дейтерия приходится ок. 0,016% общего числа атомов водорода, входящих в состав воды). Помимо доступности топлива, термоядерные источники энергии имеют следующие важные преимущества перед атомными станциями: 1) реактор УТС содержит гораздо меньше радиоактивных материалов, чем атомный реактор деления, и поэтому последствия случайного выброса радиоактивных продуктов менее опасны; 2) при термоядерных реакциях образуется меньше долгоживущих радиоактивных отходов; 3) УТС допускает прямое получение электроэнергии.
См. также:
Скорость химической реакции
Скорость реакций; Скорость реакции
величина, характеризующая интенсивность реакции химической (См. Реакции химические). Скоростью образования продукта реакции называется количество этого продукта, возникающее в результате реакции за единицу времени в единице объёма (если реакция гомогенна) или на единице площади поверхности (если реакция гетерогенна). Для исходных веществ аналогичным образом определяется скорость их расходования. Количества веществ выражают в молях (См. Моль). Тогда скорости образования продуктов и расходования исходных веществ относятся как стехиометрия, коэффициенты этих веществ в уравнении реакции. Например, в случае реакции N2 + ЗН2 = 2NH3 скорость расходования водорода в 3 раза, а скорость образования аммиака в 2 раза больше скорости расходования азота. Отношение скорости образования продукта реакции, или скорости расходования исходного вещества, к соответствующему стехиометрическому коэффициенту называется С. х. р. В случае гомогенной реакции, происходящей в закрытой системе постоянного объёма, С. х. р. 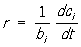 , где ci - концентрация продукта реакции, т. е. число молей его в единице объёма, bi - стехиометрический коэффициент этого вещества, t - время. Это уравнение применимо и к исходному веществу, если, как принято, стехиометрические коэффициенты исходных веществ считать отрицательными.
, где ci - концентрация продукта реакции, т. е. число молей его в единице объёма, bi - стехиометрический коэффициент этого вещества, t - время. Это уравнение применимо и к исходному веществу, если, как принято, стехиометрические коэффициенты исходных веществ считать отрицательными.
Для технических целей скорости гетерогенно-каталитических реакций обычно рассчитывают не на единицу поверхности катализатора, а на единицу массы катализатора или на единицу объёма слоя гранул катализатора.
С. х. р. может варьировать в чрезвычайно широких пределах - от очень малой (в случае геологического процессов, длящихся миллионы лет) до очень большой (в случае ионных реакций, завершающихся за миллионные доли секунды). О теории С. х. р. см. Кинетика химическая.
Для измерения С. х. р. служат разнообразные методы. Выбор метода определяется характером реакции и её скоростью. Не затрагивая реакций специальных типов (электродные, фотохимические, радиационно-химические), охарактеризуем основные методы измерения скоростей обычных реакций, обусловленных энергией теплового движения. При использовании статического метода реакцию проводят в замкнутом сосуде. О её скорости судят по изменению состава реагирующей смеси на основании анализа проб или по какому-либо свойству реагирующей смеси, зависящему от состава. В случае газовых реакций, сопровождаемых изменением числа молекул, часто следят за реакцией по изменению давления. Проточный метод заключается в том. что реагирующую смесь пропускают с постоянной скоростью сквозь зону реакции: для гетерогенной реакции - это обычно объём, заполненный гранулами катализатора; в случае гомогенной реакции - область повышенной температуры. Степень превращения исходных веществ в продукты определяют по составу смеси, выходящей из зоны реакции.
Оба указанных метода просты для осуществления, но не дают непосредственно значения С. х. р. В статической системе состав реагирующей смеси, а следовательно и С. х. р., изменяется во времени; поэтому требуется дифференцирование измеренной величины концентрации по времени для определения скорости реакции или интегрирование по времени теоретические выражения скорости реакции для сопоставления его с опытными данными. В случае проточного метода состав реагирующей смеси не зависит от времени, но различен в разных участках зоны реакции; поэтому сопоставление теоретического выражения для С. х. р. с результатами опыта требует предварительного интегрирования этого выражения по объёму зоны реакции.
Прямое измерение скорости гомогенной реакции достигается с помощью проточного перемешиваемого реактора. В сосуд, снабженный мощной мешалкой, с постоянной скоростью вводят исходные вещества и выводят реагирующую смесь так, чтобы её количество в реакционном сосуде было постоянно. При установившемся стационарном состоянии анализ отбираемой смеси показывает состав реагирующей смеси. Зная, кроме того, скорость отбора этой смеси, определяют количество вещества, образовавшегося в результате реакции за единицу времени, а отсюда - С. х. р. Для гетерогенно-каталитических процессов с неподвижным катализатором эквивалентом описанного метода является проточно-циркуляционный метод: однородность состава реагирующей смеси в зоне реакции достигается с помощью создаваемой насосом интенсивной циркуляции реагирующей смеси. Проточные перемешиваемые реакторы и проточно-циркуляционные системы принадлежат к классу безградиентных реакторов, называемых так потому, что в них практически отсутствуют градиенты (перепады) концентраций, а также температуры в зоне реакции.
Особые трудности возникают при изучении очень быстрых реакций в растворах. Если реакция успевает пройти в значительной степени за время, которое требуется для смешения растворов исходных веществ, то обычные методы непригодны. Задача измерения скоростей таких реакций решается с помощью релаксационных методов, разработанных М. Эйгеном. Система, в которой может происходить обратимая реакция, вначале находится в состоянии равновесия химического (См. Равновесие химическое). Затем весьма быстро изменяют параметр, влияющий на значение константы равновесия: температуру, давление или электрическое поле. Система переходит к новому состоянию равновесия в течение некоторого времени; этот процесс называется релаксацией (См. Релаксация). Следя за изменением состава каким-либо безынерционным методом (например, по электропроводности), определяют С. х. р. Удаётся наблюдать время релаксации до 10-6 сек: таким путём была измерена, например, скорость реакции Н++ OH- = H2O в воде.
Лит.: Кондратьев В. Н., Определение констант скорости газофазных реакций, М., 1971; Колдин Е., Быстрые реакции в растворе, пер. с англ., М., 1966; Проблемы теории и практики исследований в области катализа, под ред. В. А. Ройтера, К., 1973, гл. 3; Уэйт Н., Химическая кинетика, пер. с англ., М., 1974.
М. И. Тёмкич.
Скорость химической реакции
Скорость реакций; Скорость реакции
Скорость химической реакции — это величина, показывающая, как изменяются концентрации исходных веществ или продукт реакции за единицу времени.
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Скорость реакций; Скорость реакции
основное понятие химической кинетики. Для простых гомогенных реакций скорость химической реакции измеряют по изменению числа молей прореагировавшего вещества (при постоянном объеме системы) или по изменению концентрации любого из исходных веществ или продуктов реакции (если объем системы изменяется). Для сложных реакций скорости образования (расходования) всех веществ, участвующих в элементарных стадиях, взаимосвязаны.
Тепловой эффект химической реакции
Стандартная энтальпия образования; Энтальпия образования; Теплота образования; Энтальпия реакции; Тепловой эффект реакции; Энтальпия химической реакции; Энтальпия сгорания
Тепловой эффект химической реакции — изменение внутренней энергии \Delta U или энтальпии \Delta H системы вследствие протекания химической реакции и превращения исходных веществ (реактантов) в продукты реакции в количествах, соответствующих уравнению химической реакции (стехиометрии реакции) при следующих условиях:
Тепловой эффект реакции
Стандартная энтальпия образования; Энтальпия образования; Теплота образования; Энтальпия реакции; Тепловой эффект реакции; Энтальпия химической реакции; Энтальпия сгорания
алгебраическая сумма теплоты, поглощённой при данной реакции химической (См. Реакции химические), и совершенной внешней работы за вычетом работы против внешнего давления. Если при реакции теплота выделяется или работа совершается системой, то соответствующие величины входят в сумму со знаком минус. При постоянных температуре и объёме Т. э. р. равен изменению внутренней энергии (См. Внутренняя энергия) реагентов ΔU, а при постоянных температуре и давлении - изменению энтальпии (См. Энтальпия)ΔН. Т. э. р. выражается обычно в кдж или ккал и определяется тем количеством молей реагентов, которое соответствует стехиометрии реакции. Для отдельных типов химических реакций вместо Т. э. р. используют специальные (сокращённые) термины: Теплота образования, Теплота сгорания и т. п.
Т. э. р. зависит от температуры и давления (или объёма): зависимость от температуры выражается Кирхгофа уравнением. Для сравнения Т. э. р. и упрощения термодинамических расчётов все величины Т. э. р. относят к стандартным условиям (все реактанты находятся в стандартных состояниях (См. Стандартные состояния)). Данные по Т. э. р. получают непосредственно (см. Калориметрия) либо при изучении равновесия химического (См. Равновесие химическое) при различных температурах, а также путём расчёта, например по теплотам образования всех реагентов. При отсутствии исходных данных они могут быть оценены с помощью приближённых методов вычисления, основанных на закономерных связях между теплотами образования (теплотами сгорания) и химическим составом веществ. Т. э. р. важны для теоретической химии и необходимы при расчётах равновесных составов смесей, выхода продуктов реакций, удельной тяги топлив реактивных двигателей и для решения многих других прикладных задач (см. Термодинамика химическая).
Теплота образования
Стандартная энтальпия образования; Энтальпия образования; Теплота образования; Энтальпия реакции; Тепловой эффект реакции; Энтальпия химической реакции; Энтальпия сгорания
Тепловой эффект реакции образования вещества из каких-либо исходных веществ. Различают: Т. о. из свободных атомов; Т. о. из простых веществ, отвечающих наиболее устойчивому состоянию элементов при данных давлении и температуре; теплоту сольватации (См. Сольватация), то есть Т. о. сольватных оболочек вокруг ионов при взаимодействии веществ с растворителем; теплоту кристаллизации (См. Кристаллизация), то есть Т. о. кристаллов из частиц (атомов, молекул, ионов), образующих решётку кристаллов, и т. д. Наиболее широко используют Т. о. из простых веществ и Т. о. из свободных атомов (или противоположную ей по знаку теплоту атомизации, то есть распада молекулы вещества на составляющие её атомы). Эти величины, как правило, приводятся для веществ в стандартных состояниях (См. Стандартные состояния).
Определение Т. о. может быть выполнено различными способами: прямыми (калориметрическими) измерениями; по температурной зависимости константы равновесия реакции образования с помощью изобары (См. Изобара) или изохоры (См. Изохора) уравнения; вычислением из теплового эффекта реакции, в которой участвует данное вещество, при условии, что известны Т. о. остальных реагентов и продуктов реакции (с помощью Гесса закона); по гиббсовой энергии (См. Гиббсова энергия) и энтропии (См. Энтропия) всех реагентов; из изменения ЭДС гальванического элемента (См. Гальванические элементы) при различных температурах с помощью уравнения Гиббса - Гельмгольца; расчётом на основе многочисленных закономерностей для Т. о. различных веществ. Надёжные экспериментальные данные по Т. о. известны приблизительно для 5000 соединений. Имеющиеся величины Т. о. позволяют определять тепловые эффекты многих десятков тысяч реакций без проведения опытов. Совместно с др. данными термодинамики химической (См. Термодинамика химическая) они служат основой для расчёта изменений гиббсовой энергии, позволяющих судить о стабильности и сравнительной устойчивости различных химических соединений.
Для большого числа веществ Т. о. могут быть с хорошей степенью точности оценены с помощью закономерностей, связывающих Т. о. со строением веществ и установленных при анализе обширного экспериментального материала на основе классической теории строения химических соединений и квантовой механики молекул (см. Квантовая химия). Эти закономерности используют периодичность свойств однотипных соединений групп и периодов периодической системы элементов (См. Периодическая система элементов) Д. И. Менделеева и приближённое постоянство строения и свойств отдельных структурных фрагментов молекул в гомологических рядах (См. Гомологические ряды).
Лит.: Термические константы веществ, под ред. В. П, Глушко, М., 1965-74; Карапетьянц М. Х., Карапетьянц М. Л., Основные термодинамические константы неорганических и органических веществ, М., 1968: Cox J. D., Pilcher G., Thermochemistry of organic and organo-metallic compounds, L.-N. Y., 1970.
М. Е. Ерлыкина.
Википедия
Термоядерная реакция
Термоя́дерная реа́кция — разновидность ядерной реакции, при которой лёгкие атомные ядра объединяются в более тяжёлые за счёт кинетической энергии их теплового движения.

![Анимированная]] схема реакции дейтерий — тритий Анимированная]] схема реакции дейтерий — тритий](https://commons.wikimedia.org/wiki/Special:FilePath/Animated D-T fusion.gif?width=200)
![Ivy Mike]] Ivy Mike]]](https://commons.wikimedia.org/wiki/Special:FilePath/IvyMike2.jpg?width=200)
